CONOCIENDO EL ÁTOMO DE CARBONO
Hola, espero te encuentres muy bien, el día de hoy continuaremos con otro tema de estudio relacionado a la Química Orgánica aquí se desarrollarán contenidos que son de importancia para lograr entender todo lo que ocurre a nuestro alrededor, anteriormente aprendiste sobre los conceptos básicos y algunas características de la química orgánica, en este momento conocerás un poco más sobre el elemento base de este tipo de química: El Carbono.
Para comenzar quisiera mostrarte
esta imagen que muestra un diamante entre muchos carbones, obsérvala, analízala
y reflexiónala:
Luego de haber observado, analizado y reflexionado la imagen, te invito a que respondas estas interrogantes:
¿Cuál es tu percepción sobre el significado de esta imagen?
________________________________________________________________________________________________________________________________________________________________
¿Cuál consideras que es la relación
existente entre la imagen y el átomo de carbono?
________________________________________________________________________________________________________________________________________________________________
Una vez culminada esta impresionante lectura te voy a plantear de manera explícita el tema con el que trabajaremos en esta unidad de estudio; acá aprenderemos sobre ¿Qué es el átomo de carbono?, conoceremos sus características, sus propiedades físicas y químicas, y los enlaces que él forma, Presta mucha atención:
Es un
elemento químico con símbolo C, número atómico 6 y masa atómica 12,01. Es un no
metal y tetravalente, disponiendo de cuatro electrones para formar enlaces
químicos covalentes. El carbono es uno de los pocos elementos conocidos desde
la antigüedad, y es el pilar básico de la química orgánica. Está presente en la
Tierra en estado de cuerpo simple (carbón y diamantes), de compuestos
inorgánicos (CO2 y CaCO3) y de compuestos orgánicos (biomasa, petróleo y gas
natural). También se han sintetizado muchas nuevas estructuras basadas en el
carbono: carbón activado, negro de humo, fibras, nanotubos, fullerenos y
grafeno.
El carbono es un elemento notable por varias razones. Sus formas alotrópicas incluyen, una de las sustancias más blandas (el grafito) y una de las más duras (el diamante) y, desde el punto de vista económico, es de los materiales más baratos (carbón) y uno de los más caros (diamante). Más aún, presenta una gran afinidad para enlazarse químicamente con otros átomos pequeños, incluyendo otros átomos de carbono con los que puede formar largas cadenas, y su pequeño radio atómico le permite formar enlaces múltiples.
Así, con el oxígeno forma el dióxido de carbono,
vital para el crecimiento de las plantas (ver ciclo del carbono); con el
hidrógeno forma numerosos
compuestos denominados
genéricamente hidrocarburos, esenciales para la industria y el transporte en la
forma de combustibles fósiles; y combinado con oxígeno e
hidrógeno forma gran
variedad de compuestos como, por
ejemplo, los ácidos grasos, esenciales para la vida, y los ésteres que dan
sabor a las frutas; además es vector, a través del ciclo carbono-nitrógeno, de
parte de la energía producida por el Sol.
Las Propiedades Físicas son aquellas que pueden ser observadas y percibidas con nuestros sentidos sin cambiar la sustancia en otra sustancia. Las propiedades físicas del carbono son algo particulares. El carbono tiene propiedades que se aplican a todo el elemento en general, mientras que otros se aplican a sus alótropos. Por ejemplo: Símbolo químico (C), Masa atómica (12,01) y número atómico (6). Es un elemento no metálico y alotrópico.
El
alotropismo es una propiedad que sólo tienen ciertos elementos, como el
carbono, el azufre y el fósforo. Esto significa que la composición del elemento
de carbono le permite existir en dos o más formas distintas. En este caso, el
diamante y el grafito, que son las dos formas puras de carbono. Ubicación del
carbono en la tabla periódica.
Las Propiedades Químicas son las
características que son observables sólo a través de reacciones químicas. Es
por estos que se determina cómo el elemento reacciona con otras sustancias o
cambia de una sustancia a otra.
Para lograr entender las distintas formas que posee el carbono para enlazarse es necesario conocer su configuración electrónica que es 1s22s22p2, esto quiere decir que le faltarían o sobrarían cuatro (4) electrones para conseguir una configuración electrónica estable. En la representación de su estructura de Lewis se muestran los cuatro (4) electrones de la capa de valencia y ellos posibilitan la formación de cuatro (4) enlaces covalentes, estas propiedades hacen del carbono un elemento con una gran capacidad de combinación El átomo de carbono puede compartir uno (1), dos (2) o tres (3) pares de electrones con otro átomo, formando respectivamente un enlace sencillo, doble o triple.
ENLACE SIMPLE
Es la manera más sencilla en la que el carbono comparte sus cuatro electrones. Los enlaces se colocan apuntando a los cuatro vértices de un tetraedro regular, estando el carbono en el baricentro de dicho tetraedro. Se dice que el carbono actúa de manera tetragonal.
El
ejemplo más simple lo representa el metano, en el que un átomo de carbono
comparte cada uno de sus cuatro electrones exteriores con un átomo de
hidrógeno, de modo que tanto el carbono como cada uno de los cuatro hidrógenos
completan su última capa electrónica.
ENLACE DOBLE
El
carbono no tiene por qué formar los cuatro enlaces con cuatro átomos distintos.
Puede darse el caso de que dos de esos enlaces los forme con un mismo átomo.
Hablamos entonces de un enlace doble. Los dos electrones que le quedan al
carbono se enlazan con otros dos átomos mediante enlaces simples. En este caso,
el enlace doble y los dos simples apuntan a los vértices de un triángulo casi equilátero.
Se dice que el carbono actúa de forma trigonal.
El ejemplo más simple es el etileno, en el que los dos carbonos comparten dos electrones entre sí y los otros dos que le quedan a cada uno los comparten con dos átomos de hidrógeno.
ENLACE TRIPLE
Por último, puede el carbono formar tres enlaces con un mismo átomo, y el cuarto con un átomo distinto. Se habla entonces de un enlace triple. En este caso la molécula es lineal, y decimos que el carbono actúa de forma lineal.
El ejemplo más simple de
esto es el acetileno, en el que dos carbonos se unen mediante un enlace triple y el electrón que le
queda a cada uno lo comparten con un átomo de
hidrógeno. Por supuesto, la molécula es lineal. También puede el carbono formar
el enlace triple con otros elementos como el nitrógeno.
Después de este contenido se puede entender que el átomo de carbono tiene un rol indispensable en la química orgánica que también es conocida cómo la química del carbono, debido a que esta rama de la química estudia las propiedades de los compuestos que forma este elemento desde las moléculas complejas que intervienen en los procesos biológicos hasta las moléculas que intervienen en procesos industriales e incluso las sintetizadas en un laboratorio.
Es realmente fascinante saber la importancia que tiene este elemento químico en el planeta tierra en general, y cómo influye en todos y cada uno de los aspectos de tu vida y ahora más que nunca debes prestar atención a cada contenido que veremos en el futuro, es por ello que confiando en tu reflexión te invito a que:
Realices una lista de 5 objetos, en los que se vea manifestado el elemento carbono. Acá te dejo un ejemplo (0).
0.
En el carbón para hacer parrilla
1.
__________________________________________________________________
2.
__________________________________________________________________
3.
__________________________________________________________________
4.
__________________________________________________________________
5.
___________________________________________________________________



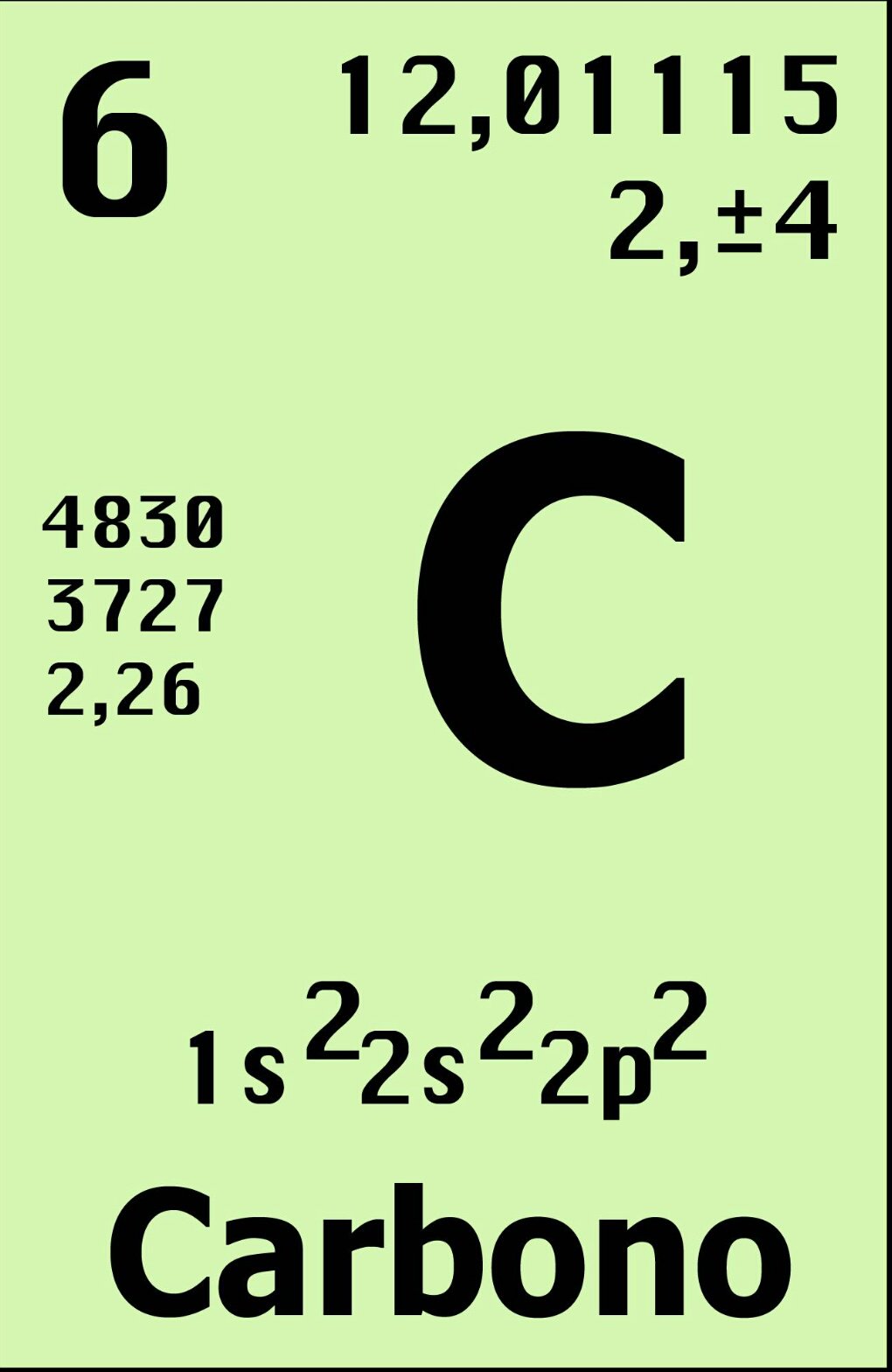











Comentarios
Publicar un comentario